
Com o impacto, o pé esquerdo de Helen escorregou da embreagem, torcendo seu tornozelo contra o piso do carro. No momento parecia ser apenas uma leve distensão, ela recorda, mas a dor nunca passava. Pelo contrário, só aumentava. Algum tempo depois, um toque mais leve, como o esfregar de um lençol, disparava choques lancinantes em sua perna. “A dor era tanta que eu não podia falar, embora por dentro estivesse gritando”, escreveu a jovem inglesa em um diário on-line sobre o mal que a atormentou pelos três anos seguintes.
A dor crônica que atinge pessoas como Helen é diferente do golpe de advertência da dor aguda. A dor aguda é a sensação mais intensa e alarmante que ocorre no corpo e tem como propósito fazer com que paremos de nos ferir. Esse tipo de dor também é chamado de dor patológica, porque uma causa externa, como um dano em algum tecido, produz os sinais que viajam pelo sistema nervoso até o cérebro, onde são interpretados como dor. Mas imagine se a agonia extrema de um ferimento nunca parasse, mesmo depois da cicatrização, ou se cada sensação comum do dia a dia se tornasse insuportavelmente dolorosa: “Eu não conseguia tomar banho... a água caía como se fossem facas”, lembra Helen. “As vibrações de um carro, alguém caminhando em um piso de madeira, pessoas conversando, uma brisa suave... tudo dava início à dor incontrolável. Analgésicos comuns… até mesmo morfina, não surtiam nenhum efeito. Era como se a minha mente estivesse pregando uma peça em mim”.
Infelizmente, Helen tinha razão. Sua dor crônica era causada por defeitos nos circuitos nervosos da dor, que os induziam continuamente a disparar um alarme falso, chamado dor neuropática, pois tem origem no comportamento indevido dos próprios nervos. Quando atingem o cérebro, os falsos sinais causam uma agonia tão real quanto qualquer dor por causas verdadeiras, embora ela nunca passe e os médicos em geral não consigam aliviá-la.
Pesquisas recentes estão finalmente elucidando por que os analgésicos tradicionais em geral são ineficazes no tratamento da dor neuropática: os alvos dos medicamentos são apenas os neurônios, enquanto a causa por trás da dor pode estar em células não neuronais disfuncionais chamadas células da glia, que se localizam no cérebro e na medula espinhal. Descobertas sobre como essas células, cuja tarefa é nutrir e regular as atividades dos neurônios, podem se desequilibrar e interromper o funcionamento neuronal inovam no tratamento da dor crônica. A pesquisa fornece ainda perspectiva surpreendente de uma conseqüência infeliz do tratamento atual contra a dor, que afeta algumas pessoas: o vício em narcóticos.
Circuitos e Interruptores da Dor
Para entender o que pode causar a persistência da dor depois da cicatrização de um ferimento, é preciso, antes de tudo, conhecer o que provoca a dor. Embora a sensação dolorosa seja percebida no cérebro, as células nervosas que a produzem não se localizam lá, mas sim na medula espinhal, coletando informações sensoriais de todo o corpo. Os neurônios dos gânglios da raiz dorsal (GRD), que representam o primeiro dos três estágios de um circuito de percepção de dor, incham seus corpos celulares, como cachos de uvas, nas juntas entre as vértebras da coluna, lembrando as fileiras duplas de botões de um paletó transpassado indo do cóccix ao crânio. Cada neurônio de GRD, como uma pessoa com os dois braços esticados, estende para fora uma antena delgada, conhecida como axônio ou fibra, para monitorar uma pequena região distante do corpo, enquanto estira seu outro axônio na medula espinhal para tocar um neurônio que retransmite impulsos pelo segundo estágio do circuito da dor, uma cadeia de neurônios da medula espinhal. Essas células espinhais transmissoras de dor reencaminham mensagens dos neurônios GRD até o estágio final, o tronco encefálico e, por fim, o córtex cerebral. Sinais de dor originados do lado esquerdo do corpo cruzam-se dentro da medula espinhal para atingir o lado direito do cérebro, e os sinais do lado direito são enviados ao lado esquerdo do cérebro.
A interrupção do fluxo de informação em qualquer ponto do circuito de três estágios da dor pode aliviar a dor aguda. Anestésicos locais, como a Novocaína usada por dentistas para extrair dente sem dor, adormecem as extremidades dos axônios em torno da região de injeção, impedindo as células de emitir impulsos elétricos. Um “bloqueio espinhal”, frequentemente usado para eliminar as dores do parto, interrompe os impulsos de dor no segundo estágio do circuito, uma vez que feixes de axônios das células dos GRD penetram a medula espinhal para se encontrar com os neurônios espinhais. Esse bloqueio deixa a mãe totalmente consciente para participar do parto indolor e auxiliá-lo. Uma injeção de morfina atua no mesmo local, reduzindo a transmissão de sinais de dor pelos neurônios espinhais enquanto as sensações não dolorosas permanecem intactas. Por outro lado, anestésicos gerais usados em grandes cirurgias interrompem o processamento de informação no córtex cerebral, deixando o paciente completamente inconsciente de qualquer entrada sensorial dos caminhos neurais fora do cérebro.
Os analgésicos naturais do nosso corpo trabalham nas mesmas três partes do circuito da dor. Um soldado em combate carregado com adrenalina pode sofrer uma grave lesão e não percebê-la, porque o córtex cerebral ignora os sinais de dor durante situações ameaçadoras e emocionalmente intensas. No parto natural, o corpo da mulher libera pequenas proteínas chamadas endorfinas, que amortecem a transmissão de sinais de dor assim que entram na medula espinhal.
Hormônios, estados emocionais e muitos outros fatores também podem alterar drasticamente a percepção de dor de uma pessoa, ao modular a transmissão de mensagens ao longo dos caminhos da dor. Além disso, muitos processos biológicos e substâncias que alteram o fluxo e o refluxo das moléculas pelos canais iônicos em células nervosas individuais contribuem em conjunto para regular a sensibilidade dos próprios nervos. Quando ocorre uma lesão, esses fatores podem facilitar os controles de disparo neuronal, auxiliando na tarefa dos neurônios de transmitir os sinais de dor.
Esse estado desimpedido, porém, pode durar tempo demais, deixando as células dos GRD hipersensibilizadas, de modo que emitam mensagens de dor sem estímulos externos. Essa situação é a causa principal da dor neuropática. O aumento da sensibilidade neuronal também pode causar sensações anormais de formigamento, queimação, cócegas e dormência (parestesia) ou, como na sensação de “chuva de facas” do caso de Helen, pode amplificar sensações leves de toque ou temperatura a níveis dolorosos (alodinia).
As tentativas de entender como os neurônios dos circuitos da dor tornam-se hipersensíveis depois de um ferimento há tempos têm se concentrado, o que não causa surpresa, nos eventuais problemas que ocorrem nos próprios neurônios – os resultados já forneceram algumas pistas, mas não um panorama completo do problema. Minha pesquisa e a de vários colegas demonstraram, por exemplo, que mesmo o ato de disparar impulsos para emitir sinais de dor altera a atividade dos genes dentro dos neurônios da dor. Alguns genes regulados por disparos neuronais codificam os canais iônicos e outras substâncias que aumentam a sensibilidade celular. A ativação intensa de células dos GRD quando algum tecido é lesionado pode então causar os tipos de mudanças de sensibilização nesses neurônios, resultando, eventualmente, em dor neuropática. Nossos estudos e o trabalho de outros laboratórios também revelam, entretanto, que os neurônios não são as únicas células que respondem a ferimentos dolorosos e liberam as substâncias que promovem a sensibilidade neural.
As células da glia são muito mais numerosas do que os neurônios na medula espinhal e no cérebro. Elas não disparam impulsos elétricos, como fazem os neurônios, mas têm algumas propriedades interessantes e importantes que influenciam a atividade neuronal. As células da glia mantêm o ambiente químico que envolve os neurônios: além de distribuírem a energia que sustenta as células nervosas, elas absorvem os neurotransmissores liberados pelos neurônios quando eles emitem um impulso a um neurônio vizinho. Às vezes as células da glia até liberam neurotransmissores para aumentar ou modular a transmissão de sinais neuronais. Quando os neurônios são lesionados, as células da glia emitem fatores de crescimento que promovem a sobrevivência e a cura neurais, e liberam substâncias que convocam as células do sistema imune a combater a infecção e promover a cura.
ANDREW SWIFT

As Células da Glia Viram Suspeitas
Cientistas já sabem que as células da glia respondem a ferimentos. Na Alemanha, em 1894, Franz Nissl notou que, depois que um nervo sofria uma lesão, as células da glia localizadas onde as fibras nervosas se conectam na medula espinhal ou no cérebro mudavam drasticamente. As células da micróglia tornam-se mais abundantes, e células maiores, chamadas de astrócitos por causa de seus corpos em forma de estrela, muito mais encorpadas, inchadas com feixes grossos de fibras filamentosas que fortificam seu esqueleto celular.
Já se compreendia que essas respostas gliais serviam para promover o reparo dos nervos após o ferimento, mas como elas agiam ainda não estava claro. Além disso, se uma lesão – como um tornozelo torcido – ocorre longe do circuito espinhal da dor, os astrócitos da espinha precisam responder não diretamente ao ferimento, mas às mudanças da sinalização no ponto de retransmissão entre os GRD e os neurônios espinhais. Essa observação implicava que os astrócitos e a micróglia monitoravam as propriedades fisiológicas dos neurônios da dor.
Durante as duas últimas décadas as células da glia demonstram ter diversos mecanismos de detecção da atividade elétrica dos neurônios, incluindo canais para detectar o potássio e outros íons liberados no disparo neuronal de impulsos elétricos; e receptores superficiais para sentir os mesmos neurotransmissores que os neurônios usam para se comunicar através das sinapses. Glutamato, ATP e óxido nítrico são alguns dos neurotransmissores importantes liberados por neurônios que são detectados pelas células da glia, mas existem muitos outros. Esse conjunto de sensores permite que as células da glia monitorem a atividade elétrica nos circuitos neuronais ao longo do corpo e no cérebro e respondam a variações de condições fisiológicas.
Assim que os cientistas reconheceram a abrangência das respostas gliais à atividade neural, as atenções se voltaram ao comportamento suspeito dessas células de suporte em pontos de retransmissão da dor. Se as células da glia estavam monitorando as transmissões neurais da dor, será que também as estariam afetando? Exatamente 100 anos depois da observação de Nissl da resposta da glia a uma lesão no nervo, um simples experimento testou pela primeira vez a hipótese de que as células da glia podem participar do desenvolvimento da dor crônica. Em 1994, Stephen T. Meller e seus colaboradores da University of Iowa injetaram em ratos toxinas que matavam seletivamente os astrócitos, e então verificaram se a sensibilidade dos animais a estímulos dolorosos tinha diminuído. Isso não ocorreu, mostrando que os astrócitos não têm um papel óbvio na transmissão de dor aguda.
Depois os cientistas trataram ratos com um irritante da fibra nervosa que fazia com que gradualmente desenvolvessem dor crônica, semelhante à maneira como o acidente de carro irritou os nervos do tornozelo de Helen. Os animais que receberam veneno contra astrócitos desenvolveram muito menos dor crônica, revelando que os astrócitos eram de alguma maneira responsáveis pelo desencadeamento da dor crônica depois da lesão no nervo.
As células da glia liberam muitos tipos de moléculas que podem aumentar a sensibilidade dos neurônios dos GRD e da medula espinhal que retransmitem sinais de dor ao cérebro, incluindo fatores de crescimento e alguns dos mesmos neurotransmissores que os próprios neurônios produzem. Os cientistas perceberam que as células da glia interpretam disparos neurais rápidos e mudanças neurais induzidas por eles como um sinal de agonia nos neurônios. Como resposta, as células da glia liberam as moléculas sensibilizantes tanto para reduzir o estresse nos neurônios, facilitando sua sinalização, como para iniciar a cura.
Outra classe vital de moléculas geradas pelas células da glia em resposta a danos ou estresse neuronais são as citocinas, abreviação de “citocinéticas”, ou seja, relativas ao movimento celular. As citocinas agem como poderosos faróis químicos que as células do sistema imune seguem para atingir o local de uma lesão. Considere o imenso problema do tipo “agulha no palheiro” que uma célula de seu sistema imune enfrenta ao encontrar uma pequena farpa na ponta do seu dedo. Citocinas potentes liberadas pelas células danificadas pela farpa alertam as células imunes do sangue e da linfa para correr até a ponta do dedo, combater a infecção e iniciar o reparo. Elas induzem também mudanças no tecido e vasos sanguíneos locais que facilitam o trabalho das células imunes e promovem a cicatrização, mas isso resulta em vermelhidão e inchaço. Os efeitos coletivos dos sinais de citocinas são chamados de inflamação.
Uma farpa demonstra quão efetivas são as citocinas ao encaminhar as células imunes a uma ferida, mas ainda mais impressionante é como uma pequena farpa pode ser dolorosa – a dor é muito desproporcional ao minúsculo dano sofrido pelo tecido. Logo, até a área circundando a farpa torna-se inchada e doloridamente sensível, embora essas células vizinhas não tenham sido danificadas. A dor em torno de uma ferida é causada por outra ação de citocinas inflamatórias: elas amplificam muito a sensibilidade das fibras de dor. Sensores de dor supersensíveis próximos a uma lesão são a maneira de o corpo fazer com que nós deixemos a região em paz para que possa cicatrizar.
Os neurônios, como regra geral, não são a fonte das citocinas do sistema nervoso – esse papel é das células da glia. E, da mesma maneira como as citocinas podem tornar hipersensíveis as terminações nervosas em torno de uma farpa no dedo, as citocinas liberadas pelas células da glia na medula espinhal em resposta aos sinais intensos de dor podem se espalhar para as fibras nervosas vizinhas e também torná-las hipersensíveis. Pode-se então iniciar um ciclo de neurônios supersensibilizados que disparam desenfreadamente, induzindo as células da glia a um estado reativo, no qual elas liberam mais fatores sensibilizantes e citocinas, na tentativa de aliviar a tensão nos neurônios, mas, ao contrário, acabam prolongando-a. Quando isso ocorre, a dor pode se originar dentro da medula espinhal a partir de fibras nervosas que não estão diretamente lesionadas.
As respostas iniciais das células da glia a uma lesão são benéficas para a cicatrização, mas, se forem intensas demais, ou se continuarem por tempos longos demais, o resultado é uma dor crônica incontrolável. Vários grupos de pesquisa têm documentado os ciclos de retroalimentação que induzem as células da glia a prolongar a liberação de fatores sensibilizantes e sinais inflamatórios que levam à dor neuropática, e muitos têm realizado experimentos para tentar reverter esses processos. Esse trabalho conseguiu até desenvolver maneiras de tornar mais efetivos os medicamentos usados para tratar a dor aguda.
FATOS DA DOR
10% a 20% da população dos Estados Unidos e da Europa afirmam sofrer de dor crônica.
59% das pessoas que sofrem de dor crônica são mulheres.
18% dos adultos com dor crônica procuram terapias medicinais alternativas. Apenas 15% dos médicos clínicos gerais sentem-se à vontade para tratar pacientes com dor crônica, de acordo com pesquisa recente.
41% dos médicos afirmaram que esperam os pacientes solicitarem especificamente analgésicos narcóticos antes de prescrevê-los.
Cortando a Dor pela Raiz
No passado, todos os tratamentos de dor crônica buscavam amortecer a atividade dos neurônios, mas a dor não pode ser interrompida se as células da glia continuarem a incitar as células nervosas. Descobertas de como as células da glia caem em seu círculo vicioso de sensibilização dos nervos criam estratégias para atingir as células da glia disfuncionais e interromper uma fonte fundamental da dor neuropática. Tentativas experimentais de tratar a dor neuropática pelo controle das células da glia focalizam-se, portanto, em aquietar essas células, bloqueando moléculas e sinais que desencadeiam o processo inflamatório, e enviando sinais anti-inflamatórios.
Em experimentos com animais, por exemplo, Joyce A. DeLeo e seus colegas da Dartmouth Medical School demonstraram que uma substância chamada propentofilina suprime a ativação dos astrócitos e, portanto, a dor crônica. O antibiótico minociclina impede que tanto os neurônios como as células da glia produzam citocinas inflamatórias e óxido nítrico, além de reduzirem a migração de micróglias na direção das lesões, sugerindo que o medicamento poderia evitar a hiperatividade glial.
Um método semelhante concentra-se nos receptores Toll-like (TLRs), proteínas superficiais das células gliais que reconhecem certos indicadores de células sob estresse e incitam as células da glia a emitir citocinas. Linda R. Watkins, da University of Colorado em Boulder, e seus colaboradores demonstraram em animais que o uso de uma substância experimental para bloquear um subtipo particular de TLR, o TLR-4, em células gliais da medula espinhal revertia a dor neuropática proveniente de lesões no nervo ciático. Curiosamente, a naloxona – fármaco usado para reduzir os efeitos de opiatos em tratamentos contra o vício – também bloqueia respostas gliais à ativação do TLR-4. Watkins demonstrou em ratos que a naloxona também pode reverter a dor neuropática totalmente desenvolvida.
Outro medicamento existente, na verdade uma antiga substância analgésica que pode ser usada quando muitas outras falham, é a maconha, legalizada para uso medicinal em alguns estados americanos. As substâncias da planta de maconha imitam compostos naturais do cérebro chamados canabinoides, que ativam certos receptores em neurônios e regulam a transmissão de sinais neurais.
Entretanto, há dois tipos de receptores de canabinoides no cérebro e no sistema nervoso: o CB1 e o CB2. Eles têm funções diferentes. A ativação do receptor CB2 alivia a dor, enquanto a ativação dos receptores CB1 induz aos efeitos psicoativos da maconha. É notável que o receptor CB2, que alivia a dor, não esteja presente nos neurônios da dor; ele aparece nas células da glia. Quando canabinoides unem-se a receptores microgliais CB2, as células reduzem sua sinalização inflamatória. Estudos recentes descobriram que, à medida que a dor crônica se desenvolve, o número de receptores CB2 da micróglia aumenta, um sinal de que as células se esforçam para tentar capturar mais canabinoides em sua vizinhança para promover alívio analgésico. Agora,as companhias farmacêuticas buscam intensamente medicamentos que possam ser usados para controlar a dor através da atuação nos receptores gliais CB2 sem drogarem as pessoas.
O bloqueio de citocinas inflamatórias usando fármacos anti-inflamatórios já existentes, como a anakinra (Kineret) e o etanercepte (Enbrel), também reduziu a dor neuropática em animais. Além de interromper sinais inflamatórios, a adição de citocinas anti-inflamatórias, como a interleucina-10 e a IL-2, pode acalmar a dor neuropática em animais, como demonstraram vários grupos. Dois medicamentos existentes, a pentoxifilina e o AV411, inibem a inflamação ao estimular as células a produzir IL-10. Além disso, grupos diversos reverteram a dor neuropática durante até quatro semanas ao injetar os genes que dão origem à IL-10 e à IL-2 nos músculos ou na espinha de animais.
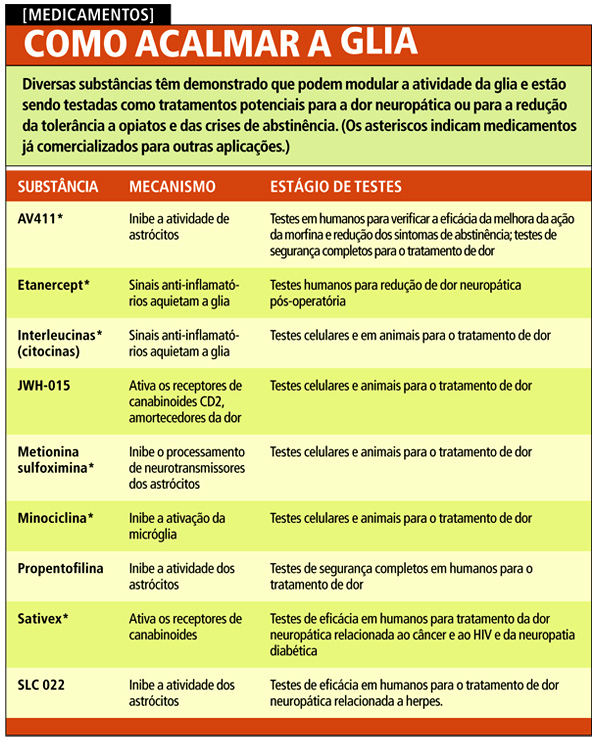
Poucos desses fármacos já foram testados contra a dor em humanos (ver tabela na pág. ao lado), incluindo o AV411, que já é utilizado como tratamento anti-inflamatório em derrames, no Japão. Um teste na Austrália mostrou que pacientes com dor voluntariamente reduziram suas dosagens de morfina enquanto estavam sendo tratados com o medicamento, um sinal de que o AV411 contribuiu para aliviar sua dor. Mas o AV411 pode estar agindo por meio de mecanismos que vão além de acalmar a dor causada pela inflamação, realçando uma reviravolta na história das células da glia e da dor.
FATORES DE RISCO PARA DOR CRÔNICA DO PESCOÇO OU DAS COSTAS
Idade avançada
Ansiedade
Ser mulher
Depressão
Levantamento de peso
Viver sozinho
Uso de nicotina
Não praticar atividades físicas
Obesidade
Trabalho repetitivo
Estresse
Insatisfação com o trabalho
Equilíbrio Restaurado
A morfina é um dos mais potentes analgésicos conhecidos, mas os médicos são cautelosos por causa de suas propriedades perversas, a ponto de muitos prescreverem doses inferiores às devidas mesmo para pacientes com câncer terminal. Como a heroína, o ópio e narcóticos modernos, como o OxyContin, a morfina ameniza a dor enfraquecendo a comunicação entre os neurônios da medula espinhal e diminuindo, assim, a transmissão dos sinais de dor.
Infelizmente, o poder da morfina e de outros narcóticos de bloquear a dor enfraquece rapidamente com o uso repetido, uma propriedade chamada tolerância. Doses mais fortes e mais frequentes tornam-se necessárias para obter o mesmo efeito. Pacientes com dor crônica podem ficar viciados, combinando seu sofrimento com uma debilitante dependência de drogas. Os médicos, temendo que sejam considerados suspeitos de traficar, em vez de prescrever quantidades tão grandes de narcóticos, são geralmente forçados a limitar os pacientes a dosagens que não são mais efetivas para aliviar sua agonia. Alguns pacientes recorrem ao crime para obter prescrições ilegais; e há até aqueles que acabam se suicidando para pôr fim a seu sofrimento. Uma nova descoberta na intersecção entre alívio de dor, glia e vício em drogas evidencia que as células da glia são as responsáveis pelo desenvolvimento da tolerância à heroína e à morfina.
As suspeitas de que as células da glia estejam envolvidas na tolerância a narcóticos surgiu com a observação de que, da mesma maneira como um viciado sofre quando larga a heroína de uma só vez, pacientes dependentes de analgésicos narcóticos que interrompem o tratamento bruscamente sofrem crises dolorosas de abstinência clássica. Os pacientes (e viciados em heroína) tornam-se tão hipersensíveis que mesmo som e luz comuns causam dores lancinantes. A semelhança entre esses sintomas e a hiperestesia observada na dor neuropática sugere a possibilidade de uma causa comum.
Em 2001, Ping Song e Zhi-Qi Zhao, do Instituto de Fisiologia de Xangai, testaram se o desenvolvimento da tolerância à morfina envolvia as células da glia. Quando deram doses repetidas de morfina a ratos, os pesquisadores viram aumentar o número de astrócitos reativos na medula espinhal. As mudanças na glia causadas pelas repetições nas doses de morfina foram idênticas àquelas observadas na medula espinhal depois de um ferimento ou quando se desenvolve a dor neuropática. Os cientistas então eliminaram os astrócitos com o mesmo veneno usado por Meller para mortecer o desenvolvimento de dor crônica em ratos. A tolerância à morfina nesses animais foi reduzida drasticamente, indicando que as células da glia contribuem de alguma maneira.
Muitos grupos de pesquisa desde então tentam bloquear sinais entre neurônios e glia (por exemplo, desativando receptores de citocinas específicos das células da glia), assim como procuram testar se a tolerância à morfina é afetada. Essa pesquisa mostra que bloquear sinais inflamatórios com destino ou origem nas células da glia não altera em nada as sensações de dor aguda normal, mas, se os bloqueadores forem injetados juntamente com morfina, doses mais baixas do analgésico são requeridas para obter o mesmo alívio, e a duração do alívio da dor é dobrada. Essas descobertas indicam fortemente que as células da glia estavam se opondo ao efeito aliviador da morfina.
As ações para minar a atuação da morfina fazem parte da tarefa fundamental das células da glia de manter a atividade equilibrada em circuitos neurais. Como os narcóticos diminuem a sensibilidade dos circuitos da dor, as células da glia respondem liberando substâncias neuroativas que elevam a excitabilidade neuronal para restaurar os níveis normais de atividade nos circuitos neurais. Com o tempo, a influência glial aumenta a sensitividade dos neurônios da dor, e, quando o efeito amortecedor dos circuitos da dor causado pela heroína ou por analgésicos narcóticos é repentinamente removido pela abstinência brusca da droga, os neurônios disparam intensamente, causando supersensibilidade e sintomas dolorosos de abstinência. Em animais de laboratório, a crise dolorosa de abstinência do vício em morfina pode ser drasticamente reduzida por medicamentos que bloqueiam as respostas gliais.
A modulação da atividade das células da glia, portanto, pode ser comprovadamente uma chave não apenas para aliviar a dor crônica, mas também para reduzir a probabilidade de desenvolvimento de vício em pessoas tratadas com analgésicos narcóticos. Pode-se imaginar quais teriam sido os benefícios que medicamentos com atuação sobre a glia teriam trazido para aqueles que há muito tempo buscaram controlar tais fontes imensas de sofrimento e tragédia para o homem. Mas as conexões entre neurônios, dor e vício se esquivaram dos cientistas do passado, que ignoravam os parceiros vitais dos neurônios – as células da glia.
| R. Douglas Fields Realizou seu mestrado no Moss Landing Marine Labs e seu doutorado em biologia oceanográfica no Scripps Institution of Oceanography. É neurobiólogo do National Institutes of Health. Em seus estudos sobre tubarões, ele conta com a colaboração da esposa, Melanie Fields, professora de biologia do ensino médio. Fora do trabalho, Fields passa seu tempo escalando, mergulhando e montando guitarras. Este é seu terceiro artigo para a SCIENTIFIC AMERICAN. |
|
|
| |